Updated on 29 Νοεμβρίου, 2020
ΜΑΘΗΜΑ ΧΗΜΕΙΑΣ ΧΗΜΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ Α ΛΥΚΕΙΟΥ
ΣΤΟΧΟΘΕΣΙΑ ΜΑΘΗΜΑΤΟΣ
Γνωστικός τομέας -Οι μαθητές θα διακρίνουν τα αντιδρώντα από τα προιόντα στις χημικές αντιδράσεις ως σώματα με διαφορετικές ιδιότητες και διαφορετική σωματιδιακή μορφή. -Οι μαθητές μπορούν να ερμηνεύουν και να συνδέουν χημικές μεταβολές που συμβαίνουν γύρω τους. -Οι μαθητές μπορούν να εκτελούν στο εργαστήριο απλές χημικές αντιδράσεις.
Συναισθηματικος τομεας
Ψυχοκινητικος τομεας
ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ
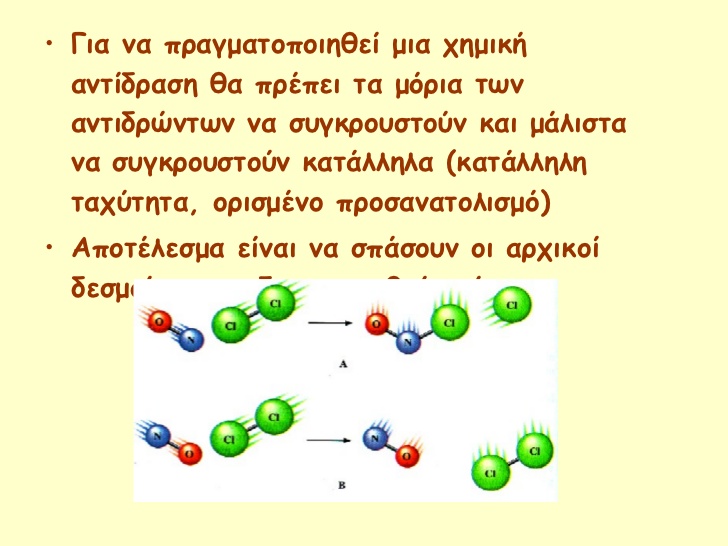
Η συμβολική απεικόνιση μιας χημικής αντίδρασης λέγεται ΧΗΜΙΚΗ ΕΞΙΣΩΣΗ
Π.χ. 2 Na + 2 H2O => 2 NaOH + H2
(Αντιδρώντα)=> (Προϊόντα)
ΕΙΔΗ ΧΗΜΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
Οι χημικές αντιδράσεις μπορούν να ταξινομηθούν σε δύο μεγάλες κατηγορίες, τις
οξειδοαναγωγικές και τις μεταθετικές.
Α. ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
Στις αντιδράσεις αυτές ο αριθμός οξείδωσης ορισμένων από τα στοιχεία που συμμετέχουν
μεταβάλλεται. Τέτοιες αντιδράσεις απλής μορφής είναι οι συνθέσεις, οι αποσυνθέσεις, οι
διασπάσεις, οι αντιδράσεις απλής αντικατάστασης. Υπάρχουν, βέβαια, και αντιδράσεις
οξειδοαναγωγής πολύπλοκης μορφής, οι οποίες όμως δε θα μας απασχολήσουν στην Α΄
Λυκείου.
1. Αντιδράσεις σύνθεσης
Κατά τις αντιδράσεις αυτές αντιδρούν δύο ή περισσότερα στοιχεία για να σχηματίσουν μία
χημική ένωση.
2. Αντιδράσεις αποσύνθεσης και διάσπασης
Κατά τις αντιδράσεις αυτές μία χημική ένωση διασπάται στα στοιχεία της (αποσύνθεση) ή σε
δύο ή περισσότερες απλούστερες χημικές ουσίες (διάσπαση).
3. Αντιδράσεις απλής αντικατάστασης
Κατά τις αντιδράσεις αυτές ένα στοιχείο που βρίσκεται σε ελεύθερη κατάσταση αντικαθιστά ένα
άλλο στοιχείο που βρίσκεται σε μία ένωση του
B. ΜΕΤΑΘΕΤΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
Στις αντιδράσεις αυτές οι αριθμοί οξείδωσης όλων των στοιχείων που μετέχουν στην αντίδραση
παραμένουν σταθεροί. Τέτοιες αντιδράσεις είναι οι αντιδράσεις διπλής αντικατάστασης και η
εξουδετέρωση.
1. Αντιδράσεις διπλής αντικατάστασης
Αντιδράσεις διπλής αντικατάστασης ονομάζονται οι αντιδράσεις μεταξύ δύο ηλεκτρολυτών σε
υδατικά διαλύματα, κατά τις οποίες οι ηλεκτρολύτες ανταλλάσσουν ιόντα, σύμφωνα με το γενικό
σχήμα : A+B–+ Γ+Δ–→ Α+Δ–+ Γ+Β–
2. Εξουδετέρωση
Εξουδετέρωση ονομάζεται η αντίδραση ενός οξέος με μία βάση. Κατά την αντίδραση αυτή τα
υδρογονοκατιόντα (H+) που προέρχονται από το οξύ ενώνονται με τα ανιόντα υδροξειδίου (OH–)
που προέρχονται από τη βάση, και δίνουν νερό :
H++ OH– → H2O
Εξαιτίας της αντίδρασης αυτής πολλές φορές εξαφανίζονται (εξουδετερώνονται) τόσο οι
ιδιότητες του οξέος (που οφείλονται στα H+) όσο και οι ιδιότητες της βάσης (που οφείλονται στα
OΗ–). Γι' αυτό και η αντίδραση ονομάζεται εξουδετέρωση.
1η δραστηριότητα:Συμπλήρωση κενών
2η δραστηριότητα:Ισοστάθμιση χημικων εξισώσεων
3η δραστηριότητα:Εξοικίωση με τον εργαστηριακό εξοπλισμό
4η δραστηριότητα:Εξοικίωση με χημικές αντιδράσεις


